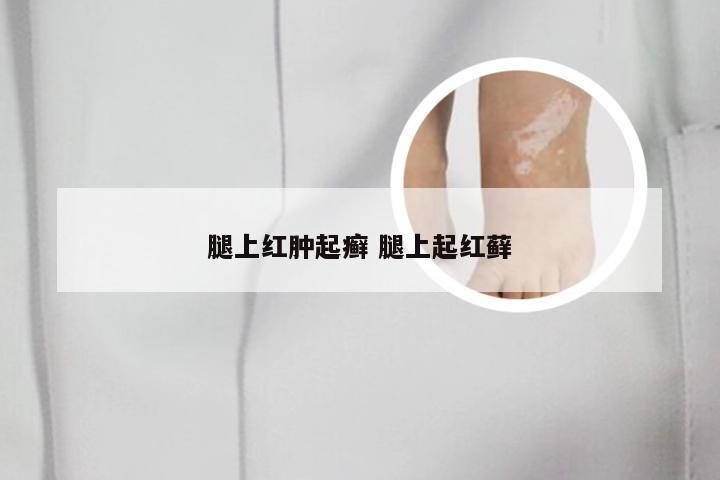
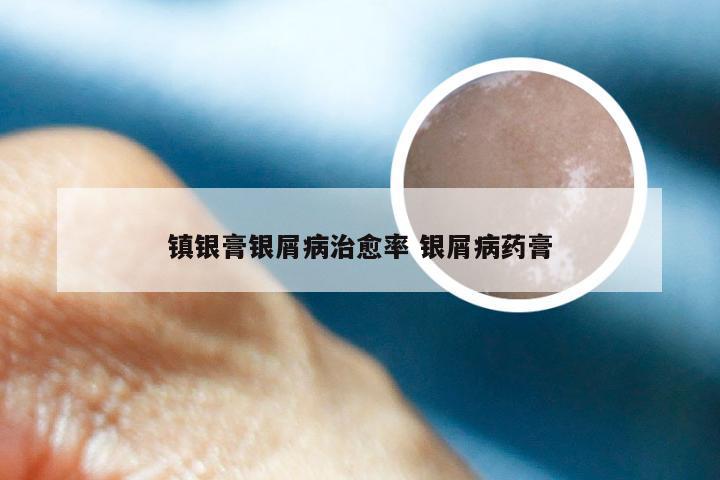
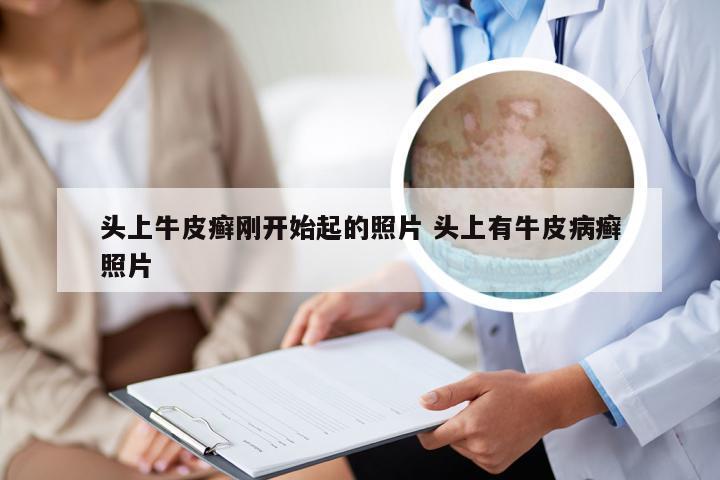
勃林格治疗银屑病的药物 勃林格 银屑病
勃林格殷格翰的公司概述
勃林格殷格翰制药公司是一家全球领先的制药企业,专注于研发和生产药品,为全球患者提供广泛的治疗选择。该公司生产了安博诺这种重要的药物,用于治疗各种疾病。
根据天眼查查询得知,勃林格殷格翰药业有限公司是一家属于一线外企的公司。勃林格殷格翰(中国)投资有限公司经过国家工信部备案许可,认证合法的经营企业,成立于2011年,勃林格殷格翰成员,位于上海市,是一家以从事商务服务业为主的企业。企业注册资本5300万美元。
勃林格殷格翰药业有限公司是一家知名的一线外企。 根据天眼查的资料,该公司是一家合法经营的企业,成立于2011年,注册地为上海市。 勃林格殷格翰(中国)投资有限公司拥有5300万美元的注册资本,并获得了国家工信部的备案许可。
勃林格殷格翰,作为一家全球运作的跨国公司,其业务主要依赖于美洲和欧洲的稳健市场。2011年,这两个区域分别贡献了其总收入的46%和31%,显示出其在成熟市场的强大影响力。然而,随着全球经济的发展,3A地区(亚洲、大洋洲和非洲)的销售额也在逐年增长。
勃林格殷格翰,作为全球最大的私人拥有的制药集团,自1885年阿尔伯特·勃林格先生在德国法兰克福附近殷格翰城创立以来,始终致力于创新药物的研发、生产和销售。这家家族企业凭借其百年历史,不断扩展业务版图,如今已遍布全球40多个国家和地区,成功跻身全球制药企业前二十强。
IL-23单抗:艾伯维$30亿银屑病品种,首个获FDA批准用于克罗恩病
艾伯维的IL-23单抗Skyrizi(risakizumab-rzaa)获得了美国FDA批准,用于治疗中度至重度活动性克罗恩病成人患者。这标志着FDA在克罗恩病治疗领域首个批准的IL-23靶向药物。克罗恩病是一种炎症性肠病,发病机制复杂,免疫系统失调是其主要特征。
IL-23抑制剂Skyrizi通过结合IL-23的p19亚基,对炎症过程具有选择性抑制作用。它已获美国FDA和欧盟批准,用于银屑病治疗,并在3期临床试验中扩展到克罗恩病和溃疡性肠炎等其他炎症疾病。新适应症包括治疗对DMARDs反应不足或不耐受的银屑病关节炎患者,单药或与甲氨蝶呤联合使用。
艾伯维宣布,欧盟委员会批准其JAK抑制剂Rinvoq(乌帕替尼)用于治疗中重度活动性克罗恩病成年患者,此批准基于三项3期临床试验数据。试验包括诱导研究(U-EXCEED和U-EXCEL)与维持研究(U-ENDURE),主要终点包括内镜反应和临床缓解,关键次要终点涉及无皮质类固醇的临床缓解与粘膜愈合等。
Humira(修美乐)是全球最畅销的药物之一,该药2013年全球销售额高达106亿美元,位列《2013年最畅销药物排行榜》榜首,2014第二季度销售额高达39亿美元,该药是艾伯维(AbbVie)的旗舰产品,也是全球首个获批的抗TNF-α单抗药物,适应症已达7个之多。
被誉为“药王”的阿达木单抗,自上市以来多年稳居全球药物销售额排行榜首,在美国、欧洲以及日本等国家和地区累计批准适应症多达17个。在中国,阿达木单抗已获批用于类风湿关节炎、强直性脊柱炎、银屑病与多关节型幼年特发性关节炎四种疾病的治疗。
勃林格殷格翰佩索利单抗佩可以预防青少年和成人泛发性脓疱型银屑病
1、该试验旨在评估佩索利单抗在预防青少年和成人泛发性脓疱型银屑病(GPP)发作方面的效果,试验结果显示,佩索利单抗能持续预防GPP发作长达48周。佩索利单抗是一种白细胞介素-36受体抑制剂抗体,其安全性数据与此前的临床试验结果一致。

罕见病怎么申请国家救助?
1、法律分析:可以申请的,要看车的价值,和大病需要的钱数为准,如果申请不到国家的大病救助,可以借助现在的大病救助平台。法律依据:《国务院关于全面建立困难残疾人生活补贴和重度残疾人护理补贴制度的意见》 (国发〔2015〕52号) 第三条 申领程序和管理办法 第一款 申领程序和管理办法 第一项 自愿申请。
2、法律分析:首先打开手机支付宝界面,首页搜索栏搜索【罕见病】,点击进入罕见病关爱中心生活号。
3、罕见病申请国家救助的方法如下:首先打开手机支付宝界面,首页搜索栏搜索【罕见病】,点击进入罕见病关爱中心生活号;点击【进入生活号】;点击进入左下角对话标识;对话框回复2,弹出申请医凯洞尺疗救助项目,点击进入详情;可以看到如何申请和有效申请时间。
...次要终点:佩索利单抗可预防泛发性脓疱型银屑病发作长达48周!_百...
1、该试验旨在评估佩索利单抗在预防青少年和成人泛发性脓疱型银屑病(GPP)发作方面的效果,试验结果显示,佩索利单抗能持续预防GPP发作长达48周。佩索利单抗是一种白细胞介素-36受体抑制剂抗体,其安全性数据与此前的临床试验结果一致。
2、研究显示,针对泛发性脓疱型银屑病(GPP),一种罕见的皮肤病,一种名为佩索利单抗的白细胞介素-36受体抑制剂抗体可以有效预防青少年和成人的GPP发作,持续时间长达48周。这一结果来自名为EFFISAYIL的临床试验,试验达到了其主要和关键次要终点。